30 jun LATERALIDADE DO CÂNCER COLORRETAL
A RELEVÂNCIA DA LATERALIDADE DO TUMOR PRIMÁRIO EM PACIENTES COM CÂNCER COLORRETAL METASTÁTICO: UMA METANÁLISE DOS PRINCIPAIS ESTUDOS DE PRIMEIRA LINHA
Existem evidências crescentes de que tumores originários do cólon direito se diferem significativamente de neoplasias do cólon esquerdo, no comportamento biológico. Anatomicamente, o cólon direito se estende do ceco até a flexura esplênica e, teoricamente, envolve também o cólon transverso. O cólon esquerdo, por sua
vez, inicia-se no ângulo esplênico e termina no sig oide, excluindo da classificação o reto¹. Cânceres do cólon direito são mais frequentes em mulheres do que em homens e, de forma geral, detêm um pior prognóstico. Notavelmente, as duas entidades distinguem-se tanto sob o ponto de vista histológico quanto molecular. À direita, observam-se lesões mais avançadas ao diagnóstico, com padrão histológico
desfavorável (como o subtipo mucinoso), e mais imunogênicas. Sob a óptica molecular, neoplasias colônicas direitas carregam mais instabilidades de microssatélites, resultantes de inativações genéticas e epigenéticas de enzimas reparadoras do DNA. E também possuem um maior número de mutação nas vias de sinalização intracelular relacionadas aos genes do RAS, RAF e PIK3CA. Em contrapartida, o câncer do cólon esquerdo exibe aberrações cromossômicas mais relevantes e maior dependência da ativação do receptor do fator de crescimento epitelial (EGFR) como inicializador proliferativo tumoral².
Diversos são os elementos atrelados a essas discrepâncias. Entretanto, o principal pilar teórico relaciona-se à
ontogênese. O intestino primitivo inicia o seu desenvolvimento embrionário na 4ª semana de gestação. Genes conhecidos como Homeobox são responsáveis pela sua diferenciação regional em três segmentos distintos. São eles o intestino anterior, que dará origem ao esôfago, estômago, duodeno, fígado, pâncreas e aparelho biliar; o intestino médio, responsável pela formação do jejuno-íleo, ceco, cólon ascendente e a maior parte do cólon transverso; e intestino posterior, que compõe o restante do cólon transverso, o cólon descendente, sigmoide, reto e porção alta do canal anal. Portanto, com base na embriologia, o cólon direito é proveniente do intestino médio (midgut), ao passo que o cólon esquerdo deriva do intestino posterior (hidgut). Cada uma dessas estruturas possui seu microambiente genético próprio, o que os torna fenotipicamente divergentes e explica o comportamento alternante.
A despeito de tudo isso, até então, a localização do tumor primário jamais havia sido empregada como estratificador de subgrupos em ensaios clínicos. Além de possuir relevância prognóstica, diversos estudos retrospectivos apontam para a localização tumoral também como preditiva de resposta a terapias direcionadas com fármacos anti-EGFR e anti-VEGF.
Dentro desse contexto, pesquisadores da Universidade de Munique, liderados por Holch, conduziram uma metanálise com os principais estudos prospectivos que abordavam o tratamento de primeira linha metastática do câncer de cólon. Os objetivos principais consistiram em se avaliar o impacto da lateralidade da lesão primária na sobrevida global (SG) e na sobrevida livre de progressão (SLP), dependendo do tratamento oferecido. E os autores também optaram por incluir no texto análises sobre a influência da localização do primário na resposta clínica a tratamentos contendo anticorpos anti-EGFR e anti-VEGF.
Dentre os 14 trabalhos avaliados, tumores de cólon direito foram identificados em 27% dos casos e, definitivamente, apresentaram piores curvas de sobrevida global (SG) do que tumores esquerdos, com medianas inferiores a 20 meses (Figura A).
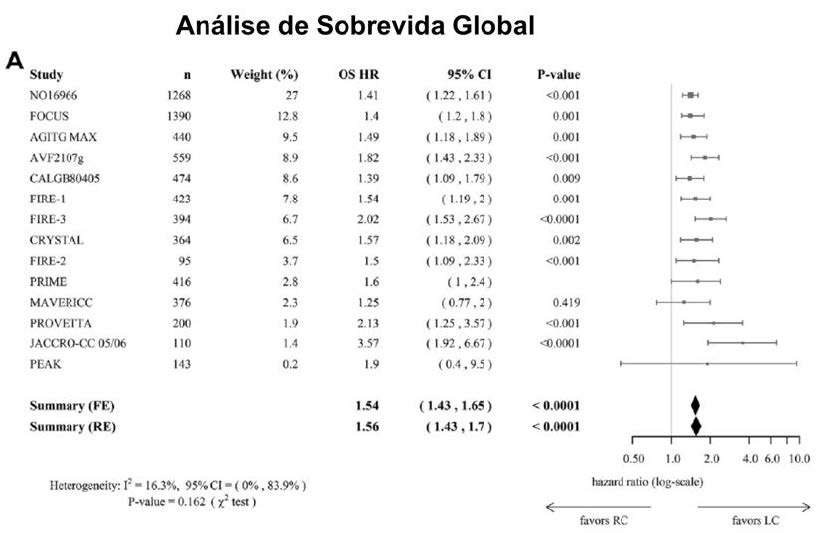
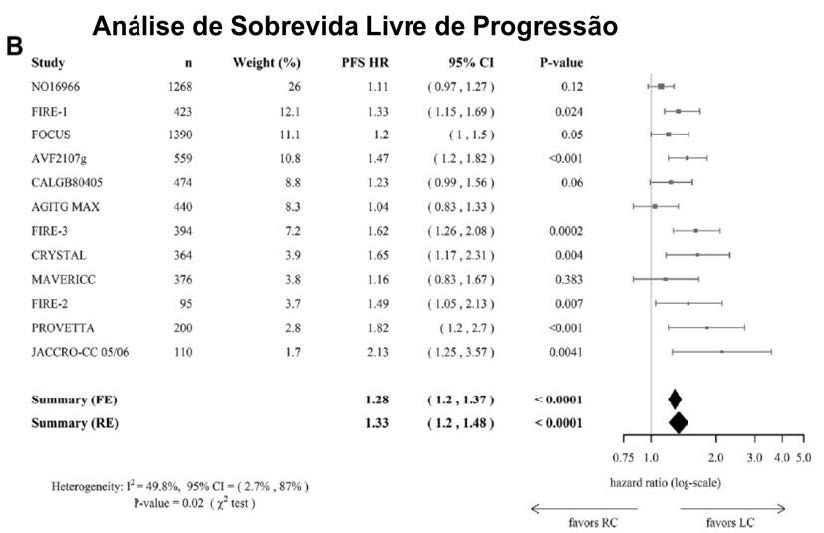
Confirmados esses achados, no Forest Plot da análise de sobrevida livre de progressão, o mesmo padrão foi observado. A posição do diamante favorece de maneira clara os tumores de cólon esquerdo, condicionando a esse grupo, novamente, melhores resultados (Figura B)³.
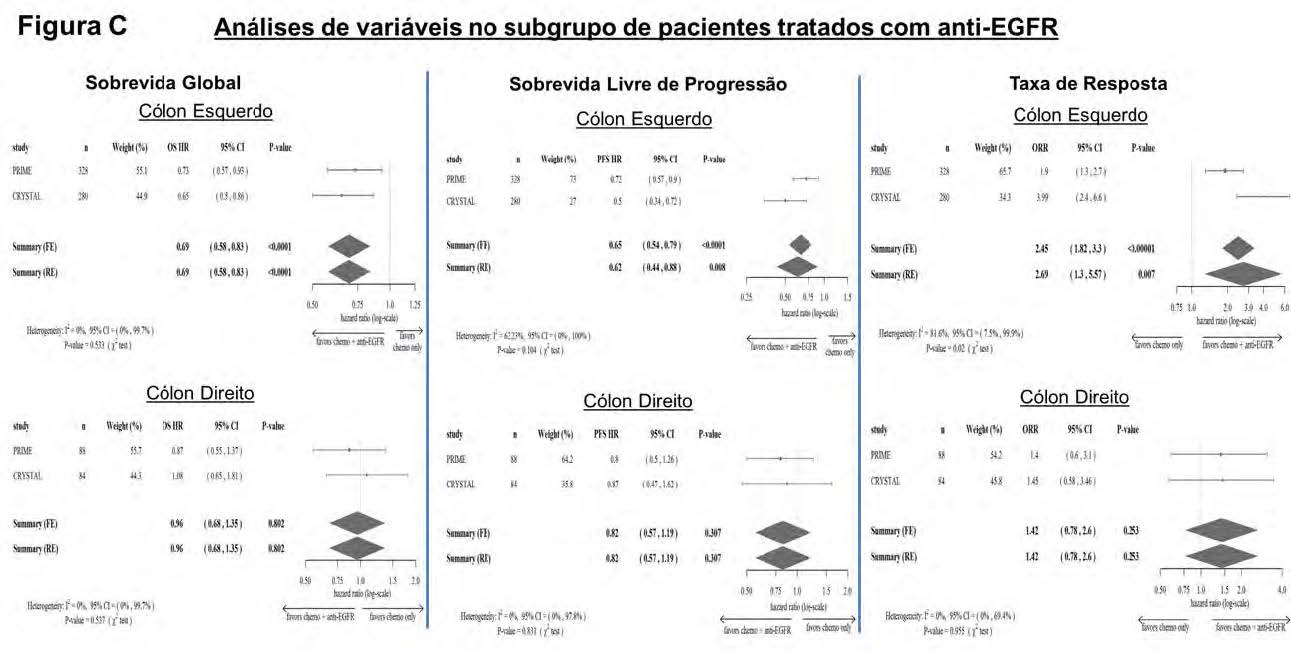
Na sequência, os autores optaram por avaliar a influência da localização do tumor na sobrevida dos pacientes tratados exclusivamente com agentes anti-EGFR associados a quimioterapia. Para tanto, elaboraram uma submetanálise, contendo apenas os estudos pivotais CRYSTAL4 e PRIME5, que pesquisaram o papel de Cetuximabe e Panitumumabe, respectivamente, na 1ª linha metastática.
Surpreendentemente, a terapia anti-EGFR somente proporcionou benefícios significativos aos indivíduos com neoplasias à esquerda com a via all-RAS selvagem. Ou seja, esse tipo de intervenção não alterou de maneira significante os desfechos avaliados em pacientes com tumores à direita, mesmo que portadores da via RAS intacta (Figura C – HR para SG no cólon esquerdo: 0,69; 95% CI: 0,58-0,83; p < 0,0001 e HR SG para cólon direito: 0,96; 95% CI: 0,68-1,35; p = 0.802)³.
Por fim, no intuito de investigar a implicação da lateralidade nas curvas de sobrevida de pacientes tratados tanto com anticorpos anti-EGFR quanto com Bevacizumabe, uma segunda submetanálise foi prospectada, dessa vez incluindo três trabalhos: FIRE-36, CALGB/SWOG 80457 e PEAK8.
Mais uma vez, em tumores de cólon esquerdo RAS selvagem, os resultados revelaram uma marcante vantagem em SG e em taxa de resposta, favorecendo os pacientes tratados com QT + anti-EGFR em detrimento dos tratados com Bevacizumabe (HR 0,71; 95% CI 0,58-0,85; p = 0,0003)³ (Figura D).
Em compensação, nas lesões de cólon direito, as terapias contendo Bevacizumabe associaram-se, numericamente, a melhores resultados. Especialmente, no que diz respeito à sobrevida livre de progressão (HR para SLP: 1,3; 95% CI 0,97-1,74; p = 0,081)³ (Figura D).

A metanálise em questão demonstra que a localização do tumor primário exerce papel prognóstico no câncer de cólon metastático. Além disso, permite, de certa maneira, inferir que pacientes com tumores de cólon esquerdo RAS selvagem devem preferencialmente ser tratados com esquemas contendo agentes anti-EGFR, na primeira linha. Pelo que indica, até o presente momento, parece não existir dados que suportem o uso de Cetuximabe ou Panitumumabe em tumores de cólon direito, ainda que possuam a via RAS intacta. Para esses pacientes, quimioterapia com Bevacizumabe pode ser uma opção mais adequada, mas ainda é necessário maior embasamento científico.
As conclusões, contudo, esbarram nas limitações inerentes a esse tipo de publicação. Os trabalhos incluídos mostravam-se demasiadamente heterogêneos quanto à fase do estudo (fase II e III), ao teste de mutações da via RAS, ao tratamento oferecido, bem como quanto à análise dos desfechos. Somado a isso, a demarcação anatômica de cólon direito e esquerdo também não foi seguida à risca por todos os artigos. Em decorrência dessas falhas metodológicas, estudos prospectivos de fase III tornam-se fundamentais para melhor entendimento do cenário.
Mesmo assim, os achados dessa metanálise têm um potencial enorme de mudar a prática clínica oncológica e de influenciar diretamente nas tomadas de decisão daqui para frente. Num futuro breve, espera-se cada vez mais frequentes descobertas moleculares que nos direcionarão progressivamente ao tratamento individualizado do câncer. Seja bem-vindo à era da oncologia personalizada.
Cordialmente,
Instituto Oncoclínicas
Referências
- Meguid, R.A., Slidell, M.B., Wolfgang, C.L. et al. Is there a difference in survival between right versus leftsided
colon cancers? Ann Surg Oncol. 2008. 15: 2388. DOI: 10.1245/s10434-008-0015-y. - Guo, H., Callaway, J.B. and Ting, J.P. Inflammasomes: Mechanism of Action, Role in Disease, and
Therapeutics. Nature Medicine. 2015. 21, 677-687. DOI: 10.1038/nm.3893. - Holch, Julian Walter et al. The relevance of primary tumour location in patients with metastatic colorectal
cancer: a meta-analysis of first-line clinical trials. European Journal of Cancer, Volume 70, 87-98. DOI:
10.1016/j.ejca.2016.10.007. - Van Cutsem E, Köhne CH, Hitre E, Zaluski J, Chang Chien CR, Makhson A, D’Haens G, Pintér T, Lim R,
Bodoky G, Roh JK, Folprecht G, Ruff P, Stroh C, Tejpar S, Schlichting M, Nippgen J, Rougier P. Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer. N Engl J Med. 2009 Apr 2;360(14):1408-
17. DOI: 10.1056/NEJMoa0805019. - Douillard JY, Siena S, Cassidy J, Tabernero J, Burkes R, Barugel M, Humblet Y, Bodoky G, Cunningham D,
Jassem J, Rivera F, Kocákova I, Ruff P, Błasińska-Morawiec M, Šmakal M, Canon JL, Rother M, Oliner KS,
Wolf M, Gansert J. Randomized, phase III trial of panitumumab with infusional fluorouracil, leucovorin,
and oxaliplatin (FOLFOX4) versus FOLFOX4 alone as first-line treatment in patients with previously
untreated metastatic colorectal cancer: the PRIME study. J Clin Oncol. 2010 Nov 1;28(31):4697-705. DOI:
10.1200/JCO.2009.27.4860. Epub 2010 Oct 4. - Jean-Yves Douillard et al. Randomized, Phase III Trial of Panitumumab With Infusional Fluorouracil,
Leucovorin, and Oxaliplatin (FOLFOX4) Versus FOLFOX4 Alone As First-Line Treatment in Patients With
Previously Untreated Metastatic Colorectal Cancer: The PRIME Study. J Clin Oncol. 2010 Nov 1;28(31):4697-
705. DOI: 10.1200/JCO.2009.27.4860. - Stintzing, Sebastian et al. FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab for metastatic
colorectal cancer (FIRE-3): a post-hoc analysis of tumour dynamics in the final RAS wild-type subgroup
of this randomised open-label phase 3 trial. The Lancet Oncology, Volume 17, Issue 10, 1426-1434. DOI:
10.1016/S1470-2045(16)30269-8. - Lenz H, et al. CALGB/SWOG 80405: Phase III trial of irinotecan/5-FU/leucovorin (FOLFIRI) or oxaliplatin/5-
FU/leucovorin (mFOLFOX6) with bevacizumab (BV) or cetuximab (CET) for patients (pts) with KRAS wildtype (wt) untreated metastatic adenocarcinoma of the colon or rectum (MCRC). ESMO. 2014:abstr 5010.
DOI: 10.1200/jco.2014.32.18_suppl.lba3. Journal of Clinical Oncology 32, no. 18_suppl – published online
before print. - Schwartzberg LS, Rivera F, Karthaus M, Fasola G, Canon JL, Hecht JR, Yu H, Oliner KS, Go WY. PEAK:
a randomized, multicenter phase II study of panitumumab plus modified fluorouracil, leucovorin,
and oxaliplatin (mFOLFOX6) or bevacizumab plus mFOLFOX6 in patients with previously untreated,
unresectable, wild-type KRAS exon 2 metastatic colorectal cancer. J Clin Oncol. 2014 Jul 20;32(21):2240-7. DOI: 10.1200/JCO.2013.53.2473. Epub 2014 Mar 31.


